Vacina contra a Covid-19: o que podemos esperar?
Em dezembro de 2019, diversos casos de pneumonia de origem desconhecida foram reportados em Wuhan, China (1). O agente causador da epidemia foi identificado como um betacoronavírus, cujo genoma apresenta 79% de homologia com a sequência gênica do coronavírus da síndrome respiratória aguda grave (SARS), de 2003, tendo sido, por isso, nomeado SARS-CoV-2 (2,3). O novo coronavírus é facilmente transmitido entre humanos, o que permitiu que se disseminasse rapidamente pelo mundo. Em 30 de janeiro de 2020, a Organização Mundial de Saúde declarou a Covid-19 (doença causada pelo SARS-CoV-2) como uma emergência de saúde pública de âmbito internacional (3,4). Diante desse cenário, torna-se urgente o desenvolvimento de uma vacina que possa ser disponibilizada rápida e globalmente.
A necessidade de desenvolver rapidamente um imunizante contra o SARS-CoV-2 surge em um momento de maior entendimento científico, inclusive em áreas como genômica e biologia estrutural, corroborando uma nova era na pesquisa de vacinas (5). Ademais, a escala do impacto humanitário e econômico da pandemia de Covid-19 vem impulsionando a pesquisa de tecnologias inovadoras para o desenvolvimento de vacinas por meio de paradigmas que acelerem seu desenvolvimento (6). No contexto de uma pandemia, uma plataforma ideal para desenvolver uma vacina seria aquela que permitisse uma rápida transição entre a fase de sequenciamento viral para a fase de ensaios clínicos, proporcionasse resposta imune duradoura, tanto humoral quanto celular, em dose única, e possibilitasse fabricação em grande escala e em um curto período (2,5,6).
Uma característica marcante do cenário de pesquisa de vacinas para Covid-19 é a variedade de plataformas tecnológicas em avaliação neste momento, incluindo ácido nucleico (DNA e RNA), partícula semelhante a vírus, peptídeo, vetor viral (replicante e não replicante), proteína recombinante, abordagens de vírus vivo atenuado e vírus inativado (tabela 1 e figura 1) (2,5–7). Tais plataformas tecnológicas têm, como principal antígeno-alvo para o desenvolvimento de um novo imunizante, a proteína Spike. Presente na superfície do coronavírus, a Spike responde pela adesão do vírus ao receptor da enzima conversora de angiotensina 2 (ACE2) em humanos, sendo também o principal indutor de anticorpos neutralizantes (3,8).
Atualmente, o cenário global de pesquisa de uma vacina contra a Covid-19 contempla 131 produtos candidatos, das quais dez se encontram em fase clínica de desenvolvimento, ou seja, sendo testadas em adultos saudáveis, a fim de avaliar sua segurança e imunogenicidade (tabela 2). As demais 121 vacinas estão em fase pré-clínica, muitas já em estudo experimental em modelos animais – para mais detalhes, acesse https://www.who.int/who-documents-detail/draft-landscape-of-covid-19-candidate-vaccines (9).
Apesar das novas plataformas, a produção de uma vacina contra o SARS-CoV-2 ainda apresenta desafios. O primeiro deles é o risco de exacerbação da doença, fenômeno observado em estudos pré- clinico, nos quais animais que haviam sido imunizados com vacina de vírus inativado contra SARS-CoV-1, quando infectados pelo vírus selvagem, desenvolveram doença mais grave, com infiltrado eosinofílico pulmonar e desvio da resposta imune para o tipo Th2 (10,11). Segundo, apesar de correlatos de proteção poderem ser inferidos dos estudos das vacinas contra SARS-CoV-1 e MERS-CoV, eles ainda não estão estabelecidos. Assim como na infecção natural, em que se desconhece a duração da imunidade protetora, também não há certeza se uma dose única será suficiente para elicitar resposta imune duradoura (5).
Por fim, o desenvolvimento de uma nova vacina é um processo demorado e caro, requerendo um novo paradigma pandêmico, com um início rápido e várias etapas executadas em paralelo, antes da confirmação de um resultado bem-sucedido da etapa anterior, o que resulta em risco financeiro elevado. O atual esforço global para a pesquisa e o desenvolvimento de imunizantes em resposta à pandemia de Covid-19 é sem precedentes, em termos de escala e velocidade. Devido à necessidade imperativa de celeridade, há uma possibilidade de que as vacinas possam estar disponíveis, sob uso emergencial ou protocolos regulatórios semelhantes, em 2021 (2,5,6).
Será necessária uma forte coordenação e cooperação internacional entre produtores, órgãos regulatórios, financiadores, órgãos de saúde pública e governos para garantir que as vacinas candidatas promissoras e em estágio avançado de desenvolvimento possam ser fabricadas em quantidades suficientes e fornecidas equitativamente a todas as áreas afetadas pela pandemia, particularmente em regiões com poucos recursos financeiros. O Coalition for Epidemics Preparedness Innovations (CEPI) emitiu recentemente um pedido de financiamento para apoiar os esforços globais de desenvolvimento de vacinas contra a Covid-19, guiados por três imperativos: velocidade, produção e implantação em escala e acesso globais (6).
Tabela 1. Visão geral das plataformas e tecnologias de produção de vacinas contra SARS-CoV-2 (2)
Plataforma | Antígeno- alvo | Plataforma com vacina já licenciada | Vantagens | Desvantagens |
Vacinas de RNA | Proteína Spike | Não |
|
|
Vacinas DNA | Proteína Spike | Não |
|
|
Vacinas de subunidade proteica | Proteína Spike | Sim: HPV, HEPB, influenza |
|
|
Vacinas de vetor viral | Proteína Spike | Sim: ebola, dengue |
|
|
Vacinas de vírus vivo atenuado | Vírus inteiro | Sim |
|
|
Vacina de vírus inativado | Vírus inteiro | Sim |
|
|
Figura 1. Vacinas candidatas por plataforma
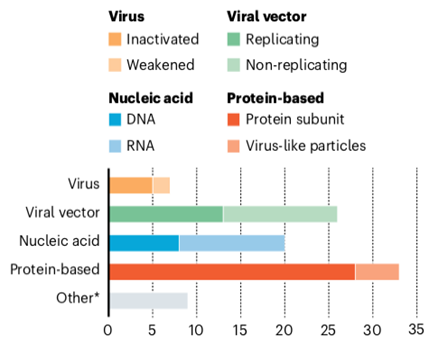
Adaptado da Nature, Vol 580 (7).
Tabela 2. Vacinas em desenvolvimento no mundo
Plataforma | Tipo de vacina candidata | Pesquisador | Fase atual de estudo clínico |
Vetor viral não replicante | Vetor: adenovírus tipo 5 | CanSino Biological Inc./Beijing Institute of Biotechnology | Fase 2 ChiCTR2000031781 Fase 1 ChiCTR2000030906 |
Vetor viral não replicante | ChAdOx1 | University of Oxford/ AstraZeneca | Fase 2b/3 2020-001228-32 |
DNA | DNA plasmid vaccine Electroporation device | Inovio Pharmaceuticals | Fase 1 NCT04336410 |
RNA | mRNA Proteína Spike | BioNTech/Fosun Pharma/Pfizer | Fase 1/2 2020-001038-36 |
RNA | mRNA | Moderna/NIAID | Fase 2 (IND accepted) Fase 1 NCT04283461 |
Inativada | Inativada | Beijing Institute of Biological Products/Wuhan Institute of Biological Products | Fase 1 ChiCTR2000031809 |
Inativada | Inativada + alumínio | Sinovac | Fase 1 NCT04352608 |
Inativada | Inativada | Institute of Medical Biology , Chinese Academy of Medical Sciences | Fase 1 |
Inativada | Inativada | Wuhan Institute of Biological Products/Sinopharm | Fase 1 ChiCTR2000031809 |
Subunidade proteica | Proteína Spike + adjuvante | Novovax | Fase 1/2 NCT04368988 |
CONSULTORIA MÉDICA EM VACINAS
Dra. Isabela Garrido da Silva Gonzalez
Dra. Janete Kamikawa
Referências
1. Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497–506.
2. Amanat F, Krammer F. Perspective SARS-CoV-2 Vaccines: Status Report. 2020;(January).
3. Wrapp D, Wang N, Corbett KS, Goldsmith JA, Hsieh CL, Abiona O, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science (80- ). 2020;367(6483):1260–3.
4. WHO. Novel coronavirus (COVID-19) situation.
5. Nicole Lurie, M.D., M.S.P.H., Melanie Saville, M.D., Richard Hatchett, M.D., and Jane Halton, A.O. PSM. Developing Covid-19 Vaccines at Pandemic Speed. N Engl J Med. 2020.
6. Thanh Le T, Andreadakis Z, Kumar A, Gómez Román R, Tollefsen S, Saville M, et al. The COVID-19 vaccine development landscape. Nat Rev Drug Discov. 2020;19(5):305–6.
7. Callaway E. The race for coronavirus vaccines: a graphical guide. Nature. 2020;580(7805):576–7.
8. Walls AC, Park YJ, Tortorici MA, Wall A, McGuire AT, Veesler D. Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell [Internet]. 2020;181(2):281-292.e6. Available from: https://doi.org/10.1016/j.cell.2020.02.058
9. DRAFT landscape of COVID-19 candidate vaccines [Internet]. [cited 2020 Jun 1]. Available from: https://www.who.int/who-documents-detail/draft-landscape-of-covid-19-candidate-vaccines).
10. Smatti MK, Al Thani AA, Yassine HM. Viral-induced enhanced disease illness. Front Microbiol. 2018;9(DEC).
11. de Alwis R, Chen S, Gan ES, Ooi EE. Impact of immune enhancement on Covid-19 polyclonal hyperimmune globulin therapy and vaccine development. EBioMedicine. 2020;55.
Outros artigos
Ginecologista, o relógio biológico de sua paciente está correndo. Seu atendimento acompanha esse tempo?
Ginecologista, o relógio biológico de sua paciente está correndo.
Investigação de hiperprolactinemia e macroprolactina
Saiba como contornar os desafios na interpretação dos resultados da dosagem de prolactina
Strain atrial: uma nova ferramenta clínica para avaliação da função cardíaca
Strain atrial: uma nova ferramenta clínica para avaliação da função cardíaca
Nirsevimabe ajuda a prevenir a infecção e complicações causadas pelo VSR em lactentes
Nirsevimabe ajuda a prevenir a infecção e complicações causadas pelo VSR em lactentes