Perda de memória e desorientação em paciente idoso
Diagnóstico exige uma abordagem multidisciplinar e deve ser feito de forma criteriosa para descartar
O CASO
Homem de 78 anos queixava-se de dificuldade progressiva de memória, iniciada dois anos antes, que atribuía a um episódio de estresse intenso relacionado à aposentadoria. Apesar de ainda realizar atividades básicas de cuidados pessoais, sua esposa relatava que ele frequentemente se esquecia de compromissos importantes, repetia perguntas e não conseguia mais acompanhar receitas culinárias, uma de suas antigas paixões. Também foi notado que ele passou a evitar encontros com amigos e apresentava dificuldade em reconhecer locais previamente familiares.
O exame físico revelou uma fala mais lenta, com dificuldades em recordar palavras específicas, mas sem alterações motoras ou comportamentais evidentes. O paciente demonstrava entendimento adequado das instruções, mas parecia desmotivado e levemente ansioso.
Para a investigação do quadro, o clínico optou por uma avaliação neuropsicológica, que revelou um quadro de síndrome amnéstica grave, do tipo anterógrada, sem quadro demencial estabelecido. A ressonância magnética (RM) do encéfalo evidenciou importante atrofia das estruturas temporais mesiais (MTA = 4), confirmado pelo estudo volumétrico (Neuroquant®) (figura 1).

Figura 1. Imagem coronal IR de RM (A), com segmentação automatizada (B). Note a redução volumétrica encefálica, com sinais de atrofia seletiva das estruturas temporais mediais, incluindo os giros para-hipocampais e o córtex entorrinal, com aumento da amplitude dos cornos temporais dos ventrículos laterais e das fissuras coróideas, bem como importante redução da altura dos hipocampos (setas), assimétrica, mais exuberante à direita (escore de MTA = 4). A tabela morfométrica (B) permite a demonstração quantitativa da atrofia seletiva das estruturas temporais mediais e a comparação gráfica com indivíduos normais do mesmo sexo e faixa etária.
Um estudo complementar com tomografia por emissão de pósitrons (PET-CT) com fluordesoxiglicose (FDG) demonstrou hipometabolismo bilateral e simétrico dos pré-cúneos e dos giros dos cíngulos posteriormente, assim como dos lobos temporais e parietais, poupando as regiões sensitivo-motoras primárias (figura 2). Por fim, um estudo de PET-CT com 18F-Florbetabeno demonstrou a deposição cortical de placa beta amiloide evidenciando captação cortical do radiofármaco de ambos os hemisférios cerebrais (figura 3).
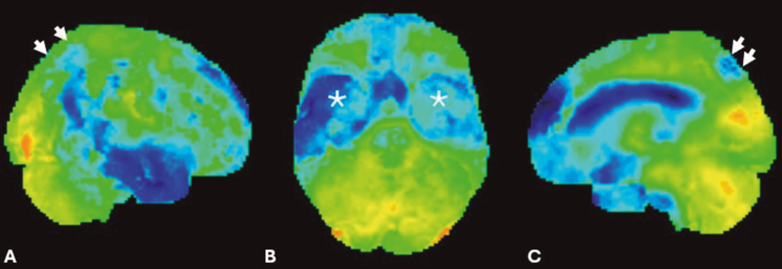
Figura 2. Imagens de PET-CT 18F-FDG com reconstruções 3D e quantificação voxel a voxel com software Scenium® com visão lateral direita (A), inferior (B) e parassagital esquerda (C) demonstram hipometabolismo bilateral e simétrico dos pré-cúneos (setas em C), assim como das regiões mediais dos lobos temporais (asteriscos em B), e a convexidade parietal bilateral (setas em A) poupando as regiões sensitivo-motoras.

Figura 3. Imagens axiais de PET-CT com 18F-Florbetabeno positivo para deposição cortical anômala de placa beta amiloide evidenciando captação cortical do radiofármaco, sem delimitação nítida da transição entre a substância branca e cinzenta.
A DISCUSSÃO
Existem diversas causas de demência, que vão desde quadros progressivos, em que o sintoma compõe a principal manifestação de uma entidade clínica específica, como na doença de Alzheimer (DA), até parte de um quadro neurológico estático, como nas sequelas de lesões corticais por encefalite.
O diagnóstico, portanto, exige uma abordagem multidisciplinar e deve ser feito de forma criteriosa para descartar enfermidades tratáveis.
O diagnóstico presuntivo da DA é baseado no quadro clínico e na avaliação por exames laboratoriais e de imagem - com esses resultados é possível chegar ao diagnóstico provável de DA. Assim, considera-se a condição provável quando, excluídas outras hipóteses, especialmente a doença cerebrovascular, critérios clínicos e cognitivos são satisfeitos e reforçados pelos seguintes aspectos:
- Evidência de declínio cognitivo progressivo documentado em avaliações subsequentes, com base nos testes rápidos do status mental ou neuropsicológico formal e em dados de informantes.
- Presença de um ou mais dos seguintes marcadores:
-Proteína βA-42 diminuída e aumento da proteína Tau fosforilada e da Tau total no liquor;
-Proteína amiloide positiva no exame PET-CT amiloide;
-Redução da captação de FDG no córtex temporoparietal no exame de PETCT cerebral;
-Atrofia desproporcional das estruturas mediais temporais, principalmente o hipocampo, do lobo temporal, basal e lateral e do córtex parietal medial na RM convencional.
-Mutação genética autossômica dominante para DA comprovada (PSEN1, PSEN2, APP).
Os estudos morfológicos de RM demonstraram a atrofia desproporcional das estruturas mesiais temporais, envolvendo o córtex entorrinal, os giros para-hipocampais e os hipocampos, cujo volume encontrava-se abaixo do percentil normativo de 1 para a faixa etária e gênero. Esse achado constitui a pedra angular do diagnóstico presuntivo por imagem da DA, evidentemente dentro de contexto clínico e laboratorial apropriado.
Diversas técnicas de medida volumétrica de estruturas temporais mediais (amígdala, hipocampo e giro para- hipocampal) têm sido utilizadas na última década, com potencial aplicação clínica na investigação de doenças neuropsiquiátricas. Recentes avanços tecnológicos tornaram possível o desenvolvimento de softwares de análise morfométrica automáticos, como o Neuroquant®, que minimiza os problemas referentes à reprodutibilidade do método. Ademais, o uso desse sistema permite a comparação dos valores obtidos no paciente com valores normais de uma base de dados corrigidos por sexo, idade e tamanho da cabeça.
Em relação à RM, vale ressaltar que o método reconhecidamente consegue demonstrar alterações nas fases em que já se observam manifestações clínicas que permitem o diagnóstico de DA.
Exames funcionais como o PET-CT podem contribuir na demonstração de alterações funcionais mais precoces, que eventualmente antecedam o comprometimento evidente nos estudos de neuroimagem estrutural, tendo fundamental aplicação nos casos em que as alterações na RM se mostram inespecíficas.
O padrão observado no paciente do estudo é aquele usualmente observado na DA, o que pode favorecer o diagnóstico presuntivo da doença no contexto clínico apropriado.
CONHEÇA OS NOVOS EXAMES PARA A INVESTIGAÇÃO DA DOENÇA DE ALZHEIMER
PET-CT cerebral para detecção de placa amiloide
Nos últimos anos, a identificação da presença de placas βA cerebrais in vivo tem se tornado um importante avanço no diagnóstico da DA, norteando o desenvolvimento de novos exames na medicina nuclear, que possibilitam a avaliação de indivíduos em estágio préclínico (assintomáticos), com declínio cognitivo leve e também com o quadro demencial já estabelecido.
Uma vez que o radiofármaco florbetabeno marcado com flúor-18 (18F-florbetabeno) é absorvido pelo tecido cerebral e tem alta afinidade pela βA, com excelente perfil de segurança, o exame de PET-CT feito com esse marcador vem sendo utilizado de forma bem-sucedida nesse contexto.
Quando positivo, consegue confirmar a presença do depósito de βA em pacientes com suspeita clínica, assim como sugerir uma possível progressão do quadro para DA em indivíduos com declínio cognitivo leve ou mesmo antes do aparecimento dos sintomas. Já quando negativo, ou seja, sem evidenciar depósito de βA nas estruturas corticais, mas apenas na substância branca, exclui o diagnóstico da condição, dada a sensibilidade do método.
Dessa forma, o estudo de PET-CT para detecção de placa amiloide ajuda a investigar pacientes com diagnóstico clínico de demência, mas sem etiologia definida, além daqueles com declínio cognitivo leve, a fim de melhor compreender a probabilidade de evolução do quadro. Com a disponibilidade de novos medicamentos direcionados à redução da deposição das placas beta-amiloides, atualmente, o método ainda pode ser útil na seleção de pessoas elegíveis a tratamento, auxiliando o controle da doença.
Biomarcadores em sangue periférico - Precivity AD2TM
O PrecivityAD2TM é um teste inovador, realizado em sangue periférico, que determina a presença das placas βA cerebrais por meio de biomarcadores plasmáticos. O Grupo Fleury firmou um acordo com a C₂N Diagnostics (EUA), desenvolvedora do exame, e o trouxe para o Brasil de forma pioneira.
Validado analítica e clinicamente, o PrecivityAD2TM quantifica, simultaneamente, a concentração dos marcadores neuropatológicos da doença no plasma: as proteínas βA40 e βA42 e os peptídeos tau-fosforilado 217 (p-tau217) e não fosforilado 217 (np-tau217).
Se o principal desafio para a análise desses biomarcadores no sangue periférico é o baixo nível plasmático de tais moléculas, o exame supera essa limitação por meio de tecnologias ultrassensíveis, como a imunoprecipitação seguida por cromatografia líquida acoplada à espectrometria de massas (LC/MS), métodos capazes de mensurar, de modo acurado, as proteínas do sistema nervoso central no plasma.
O teste ainda estabelece as razões βA42/βA40 e p-tau217/np-tau217, importantes para mitigar o efeito de fatores interferentes, a exemplo de doença renal crônica.
As variáveis avaliadas passam por um algoritmo de propriedade da C₂N Diagnostics, o qual calcula o escore de probabilidade amiloide 2 (APS2, na sigla em inglês), um valor numérico que varia de 0 a 100 e, assim, indica um resultado negativo (APS entre 0 e 47) ou positivo (APS entre 48 e 100) para a presença de placas amiloides, com acurácia significativa quando comparada ao estudo de PET-CT amiloide.
O PrecivityAD2TM foi desenhado para investigar a DA em indivíduos com idade igual ou superior a 55 anos, sinais ou sintomas de declínio cognitivo leve ou de demência e suspeita de DA ou de outras causas de comprometimento da cognição.
Os resultados são fornecidos em formato de relatório e sua interpretação exige cuidado, devendo sempre considerar o quadro clínico subjacente, os testes neurológicos e cognitivos e outros exames complementares.

Consultoria médica:
Dr. Antonio Carlos M. Maia Jr.
Consultor médico em Neuroimagem
Dr. Aurélio Pimenta Dutra
Consultor médico em Neurologia
Dr. Carlos Jorge da Silva
Consultor médico em Neuroimagem
Dr. Carlos Toyama
Consultor médico em Neuroimagem
Dra. Claudia da Costa Leite
Consultora médica em Neuroimagem
Dr. Douglas Mendes Nunes
Consultor médico em Neuroimagem
Dra. Germana Titoneli dos Santos
Consultora médica em Neuroimagem
Dr. Leandro Tavares Lucato
Consultor médico em Neuroimagem
Dr. Lucas Avila Lessa Garcia
Consultor médico em Neuroimagem
Dr. Luiz Antonio Pezzi Portela
Consultor médico em Neuroimagem
Dr. Marco A. C. Oliveira
Consultor médico em Medicina Nuclear
Outros artigos
Ginecologista, o relógio biológico de sua paciente está correndo. Seu atendimento acompanha esse tempo?
Ginecologista, o relógio biológico de sua paciente está correndo.
Investigação de hiperprolactinemia e macroprolactina
Saiba como contornar os desafios na interpretação dos resultados da dosagem de prolactina
Strain atrial: uma nova ferramenta clínica para avaliação da função cardíaca
Strain atrial: uma nova ferramenta clínica para avaliação da função cardíaca
Nirsevimabe ajuda a prevenir a infecção e complicações causadas pelo VSR em lactentes
Nirsevimabe ajuda a prevenir a infecção e complicações causadas pelo VSR em lactentes