Queixa de "perda de memória" e de alterações da fala e do comportamento
Que possibilidades considerar após avaliar os dados clínicos e os estudos de imagem?
Mulher de 69 anos, destra, foi encaminhada para uma consulta neurológica por queixas envolvendo a "memória" e alteração do comportamento. Familiares começaram a notar, dois anos antes, problemas na compreensão de palavras, percebidos pela frequência de perguntas como: "O que é uma chave de fenda?" ou "O que é um bufê?". Segundo relato, circunlocuções tornaram-se cada vez mais comuns, a exemplo da descrição de uma pizza como uma "coisa redonda". Posteriormente, a paciente passou a ter dificuldades no reconhecimento de objetos e pessoas e deixou de realizar tarefas domésticas, pois parecia confusa ao tentar fazê--las. No histórico familiar, havia alguns parentes do lado materno com antecedentes semelhantes e diagnóstico de doença de Alzheimer.
Ao exame clínico, ficaram evidentes preenchimentos frequentes no discurso, como a palavra "coisa". Suas respostas a perguntas diretas foram tangenciais. O restante de seu exame neurológico mostrou-se normal. Em testes cognitivos, a paciente marcou 8 em 30 no miniexame do estado mental (MMSE), geralmente sem entendimento da questão que estava sendo feita. A fluência semântica estava severamente prejudicada, com apenas dois animais nomeados em um minuto. Em contraste, a fluência fonêmica estava apenas ligeiramente prejudicada.
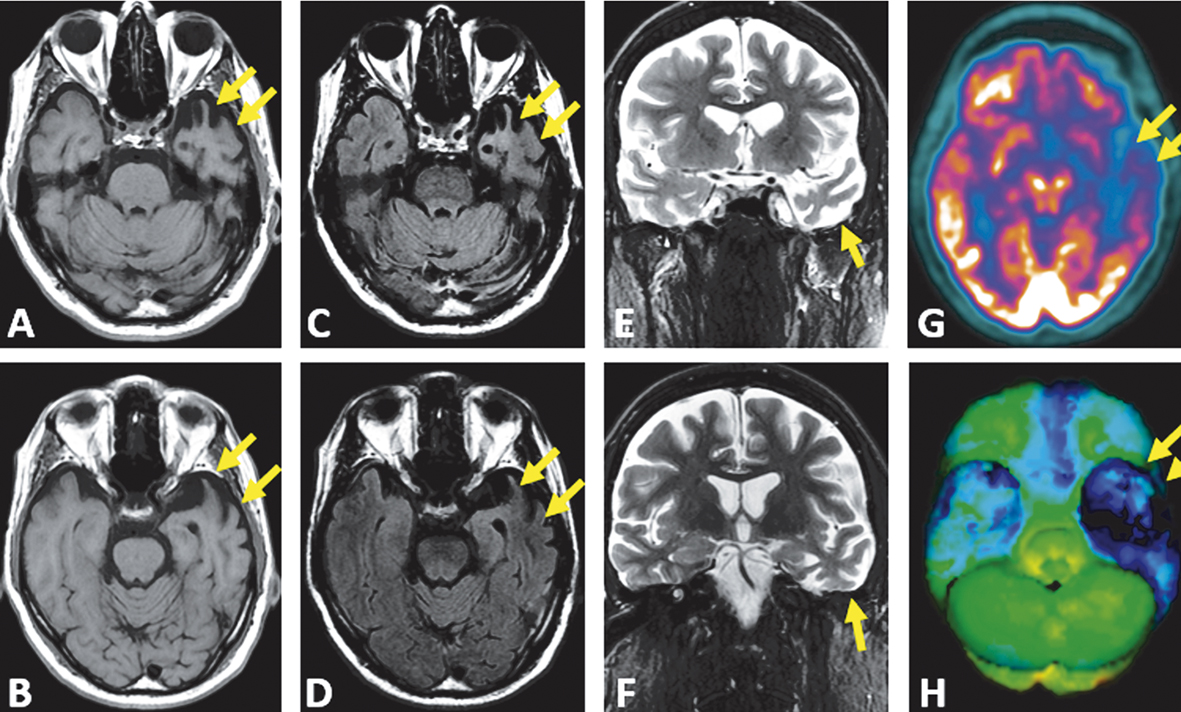
Imagens axiais T1 (A e B) e FLAIR (C e D) e imagens coronais T2 (E e F). Imagens de PET-FDG axial (G) e reconstrução 3D (H). Nota-se atrofia desproporcional do polo temporal esquerdo (setas). Os giros estão afilados e os espaços liquóricos, alargados. Nas imagens FLAIR, destaca-se o hipersinal da substância branca com perda da diferenciação corticossubcortical. O estudo de PET-FDG evidencia importante hipometabolismo do lobo temporal esquerdo (setas), com comprometimento menos relevante do lobo temporal contralateral e dos lobos frontais.
Diante das alterações observadas, qual o diagnóstico?
- Afasia primária progressiva
- Doença de Alzheimer
- Demência de corpúsculos de Lewy
Resposta do caso de queixa de "perda de memória" e de alterações da fala e do comportamento
A paciente manifestava a apresentação clássica da variante semântica da afasia primária progressiva (APP). Nessa situação, não raras vezes os familiares podem identificar a queixa principal como déficits de memória, mas, com uma avaliação cuidadosa, fica claro que a perda do significado das palavras e os déficits de compreensão estão por trás das mudanças observadas.
Incluídos no grupo das demências frontotemporais (DFT), os indivíduos com variante semântica da APP exibem marcada atrofia no polo temporal anterior dominante e demonstram anomia e déficits de compreensão de palavras. Embora a fluência e a gramática sejam geralmente mantidas, a fala se torna cada vez mais vazia, com palavras vagas ou jargões substituindo substantivos e verbos.
Ao contrário do que ocorre na doença de Alzheimer (DA), esses pacientes apresentam boa memória autobiográfica e manutenção das habilidades visuoespaciais e perceptivas, além de relativa preservação da capacidade de resolver problemas não verbais. Podem ainda exibir alterações comportamentais, em grande parte sobrepostas às descritas para a variante comportamental da DFT, provavelmente devidas ao acometimento do lobo temporal anterior direito e às conexões com o córtex orbitofrontal.
À medida que a doença progride e começa a acometer as regiões temporais posteriores e as áreas de associação temporal visual, existe também a possibilidade de desenvolvimento de agnosia visual e prosopagnosia.
Critérios diagnósticos para a variante semântica da APP
I. Diagnóstico clínico da variante semântica da APP Ambos os seguintes aspectos principais devem estar presentes:
- Dificuldades na nomeação em situações de confronto
- Dificuldades na compreensão de palavras isoladas
Pelo menos três dos seguintes aspectos adicionais de diagnóstico devem estar presentes:
- Dificuldades no conhecimento de objetos, especialmente para itens de baixa frequência ou familiaridade
- Dislexia superficial ou disgrafia
- Repetição preservada
- Produção da fala preservada (gramática e fala motora)
II. Diagnóstico com suporte de imagem da variante semântica da APP
Ambos os seguintes critérios devem estar presentes:
- Diagnóstico clínico da variante semântica da APP
- Um ou mais dos seguintes resultados nos estudos de imagem:
- Atrofia predominante no lobo temporal anterior
- Hipoperfusão ou hipometabolismo predominante no segmento anterior do lobo temporal na tomografia por emissão de fóton único (Spect) ou na tomografia por emissão de pósitrons (PET)
III. Variante semântica da APP com patologia definitiva
O diagnóstico clínico e qualquer um dos critérios abaixo devem estar presentes:
- Evidência histopatológica de uma patologia neurodegenerativa específica (por exemplo, degeneração lobar frontotemporal-tau, degeneração lobar frontotemporal-TDP, doença de Alzheimer ou outra)
- Mutação patogênica conhecida
Diagnóstico com múltiplas ferramentas
Os estudos de imagem têm papel fundamental em tais casos, uma vez que participam dos critérios de diagnóstico. O padrão da imagem tipicamente associado a essa condição é de atrofia ou hipometabolismo do polo temporal do hemisfério dominante – o esquerdo, na maioria dos indivíduos acometidos. No contexto clínico apropriado, a identificação de sinais de atrofia seletiva dessas regiões permite identificação da variante semântica da APP suportada por imagem.
A doença é definida por estudo histopatológico – embora raramente utilizado – ou por meio de comprovação de uma mutação patogênica conhecida. Assim como se dá em qualquer DFT, a APP apresenta uma base genética complexa, que pode ser classificada em diferentes subtipos, de acordo com as proteínas anômalas presentes no cérebro.
As três principais proteínas associadas a essas condições são a tau (FTLD-tau), a proteína TDP-43 (FTLD-TDP) e a proteína Fus (FTLD-Fus). O sequenciamento completo das regiões codificantes e flanqueadoras adjacentes aos éxons dos genes relacionados à DFT, feito por sequenciamento de nova geração (NGS), e a pesquisa de expansão de hexanucleotídeos do gene C9orf72, realizada por PCR, seguida da análise do tamanho de fragmentos, são os exames de escolha para a investigação genética.
Na paciente em estudo, foi detectada a mutação no gene GRN (progranulina). Contudo, nem todos os casos de APP são hereditários ou ocasionados por alterações genéticas conhecidas – algumas formas da doença ocorrem de modo esporádico e não possuem causa genética identificada.
Alterações genéticas mais comuns associadas à APP e a outras formas de DFT
- Mutação no gene C9orf72: alteração genética mais comum associada à DFT, incluindo a APP. A expansão anormal do hexanucleotídeo GGGGCC no gene C9orf72 é a causa mais frequente da forma hereditária da doença.
- Mutação no gene GRN (progranulina): relacionada à forma hereditária de DFT, incluindo a variante semântica da APP. A progranulina é uma proteína que participa da regulação da inflamação e da manutenção da saúde das células nervosas.
- Mutação no gene MAPT (tau): pode levar à produção anormal da proteína tau e está associada a uma forma de DFT conhecida como DFT-tau, que tem sobreposições com a variante logopênica da APP.
- Outras mutações raras: além das três principais proteínas envolvidas com esses quadros, outras mutações genéticas menos comuns podem estar envolvidas na patogênese da APP.
Atualmente, a análise do liquor (LCR) pode ajudar a distinguir entre DFT e DA, mas não há biomarcadores validados capazes de distinguir com segurança pacientes com DFT de controles ou outras demências não relacionadas à DA.
A presença do padrão característico para DA – redução da proteína amiloide 42 (ßA 42), aumento da proteína tau fosforilada (tau-F) e da tau total (tau-T) e diminuição das razões ßA42/ßA40, tau-F/ßA42 ou tau-T/ßA42 – é compatível com Alzheimer e discrimina a doença da DFT, com sensibilidade e especificidade que variam de 80% a 95%.
Já na DFT, os níveis de tau-T podem estar elevados, mas as proteínas ßA42 e tau-F são normais. Vários biomarcadores candidatos do LCR estão atualmente sob investigação, incluindo neurofilamentos de cadeias leves, TDP-43 e progranulina. Baixos níveis séricos de progranulina podem prever o estado de mutação do GRN em portadores e pacientes. No entanto, os níveis séricos e liquóricos dessa proteína são apenas modestamente correlacionados e exibem variações em função de idade, sexo e outros fatores genéticos.
Consultoria Médica
Neuroimagem
Dr. Antonio Carlos M. Maia Jr.
[email protected]
Dr. Carlos Jorge da Silva
[email protected]
Dr. Carlos Toyama
[email protected]
Dra. Claudia da Costa Leite
[email protected]
Dr. Douglas Mendes Nunes
[email protected]
Dra. Germana Titoneli dos Santos
[email protected]
Dr. Leandro Tavares Lucato
[email protected]
Dr. Lucas Avila Lessa Garcia
[email protected]
Dr. Luiz Antonio Pezzi Portela
Neurologia
Dr. Aurélio Pimenta Dutra
Genética
Dr. Wagner Antonio da Rosa Baratela
[email protected]
Medicina Nuclear
Dr. Marco Antonio Condé Oliveira
[email protected]
Outros artigos
Ginecologista, o relógio biológico de sua paciente está correndo. Seu atendimento acompanha esse tempo?
Ginecologista, o relógio biológico de sua paciente está correndo.
Investigação de hiperprolactinemia e macroprolactina
Saiba como contornar os desafios na interpretação dos resultados da dosagem de prolactina
Strain atrial: uma nova ferramenta clínica para avaliação da função cardíaca
Strain atrial: uma nova ferramenta clínica para avaliação da função cardíaca
Nirsevimabe ajuda a prevenir a infecção e complicações causadas pelo VSR em lactentes
Nirsevimabe ajuda a prevenir a infecção e complicações causadas pelo VSR em lactentes