Ressonância magnética no complexo universo das doenças desmielinizantes
A esclerose múltipla (EM) é a doença desmielinizante adquirida mais prevalente em adultos. Clinicamente, caracteriza-se por sintomas neurológicos recorrentes, que afetam múltiplos sistemas neurais. Embora a correta caracterização de surtos neurológicos seja bastante sugestiva do quadro, esse caráter é inespecífico, podendo se sobrepor a diversas síndromes. Desde a descrição dos primeiros critérios diagnósticos de McDonald, em 2001, foram incluídos os achados de imagem por ressonância magnética (RM), hoje considerada a ferramenta paraclínica mais importante no diagnóstico da EM.
A RM possibilita confirmar a distribuição espacial (tabela 1) das placas desmielinizantes precocemente (figura 1), caracterizando-as já no momento do primeiro sintoma, podendo abranger lesões sintomáticas e assintomáticas na definição de disseminação espacial. A quantidade de lesões assintomáticas auxilia também a estimativa do risco de conversão para EM clinicamente definida, bem como o estabelecimento de fatores prognósticos. Nas revisões mais recentes dos critérios de McDonald (2010 e 2017), é possível demonstrar a disseminação temporal (tabela 1) da EM pela RM (figura 2), permitindo a definição do diagnóstico e autorizando o neurologista a iniciar a terapia específica mais indicada.


Figura 1 | Locais típicos para definição de disseminação espacial em EM. Nos novos critérios de McDonald 2017, é necessário detectar lesões com alto sinal em T2 em, pelo menos, dois dos espaços encefálicos: periventricular (A), justacortical ou cortical (B), infratentorial (C) e medular (D).
 Figura 2 | Exemplos de disseminação temporal. (A) Exame inicial demonstra uma lesão periventricular e uma justacortical (setas). (B) RM realizada após quatro meses aponta o surgimento de uma nova lesão. Nas figuras (C) e (D), verifica-se como é possível estabelecer o critério de disseminação temporal em um único exame, com a detecção de múltiplas lesões crônicas com hipersinal em T2 (C) juntamente com duas lesões agudas, caracterizadas por realce pelo gadolínio (D).
Figura 2 | Exemplos de disseminação temporal. (A) Exame inicial demonstra uma lesão periventricular e uma justacortical (setas). (B) RM realizada após quatro meses aponta o surgimento de uma nova lesão. Nas figuras (C) e (D), verifica-se como é possível estabelecer o critério de disseminação temporal em um único exame, com a detecção de múltiplas lesões crônicas com hipersinal em T2 (C) juntamente com duas lesões agudas, caracterizadas por realce pelo gadolínio (D).
Além de ser usada para a verificação dos critérios diagnósticos, a RM é imprescindível para a análise da forma das lesões de EM e para a detecção de sinais que indiquem sua típica distribuição perivenular. As sequências T2 e FLAIR com cortes finos ou volumétricas mostram-se fundamentais para a identificação de lesões ovaladas predominantemente perpendiculares à superfície ependimária e para a identificação de lesões justacorticais (figuras 3a e 3b). Na região infratentorial e na medula espinhal, a combinação de imagens ponderadas em T2 e em densidade de prótons (DP) com cortes finos possui maiores sensibilidade e especificidade para a caracterização das placas desmielinizantes (figuras 3c e 3d). Na medula espinhal, o uso de cortes axiais contribui para definir a localização das lesões na secção transversal (figuras 3e e 3f), contribuindo, como veremos a seguir, para o diagnóstico diferencial.

Figura 3 | As sequências FLAIR (A e B) são as mais utilizadas para a detecção de placas desmielinizantes da EM, uma vez que permitem observar a forma ovalada das lesões, com orientação perpendicular à superfície ependimária (A). Também possuem boa sensibilidade para identificar lesões justacorticais e eventual acometimento cortical (B). Na região infratentorial (C e D), porém, as sequências ponderadas em T2 (D) são mais sensíveis para a caracterização dessas lesões, na medida em que possibilitam detectar um número maior de lesões e com menos artefatos em relação à sequência FLAIR (C). Na medula espinhal, a sequência ponderada em densidade de prótons (E) é a mais sensível para a identificação das lesões desmielinizantes. Os cortes axiais (F) mostram-se importantes para detectar as localizações mais típicas de lesões de EM, geralmente pequenas e com localização excêntrica, na secção transversa.
Além das sequências estruturais obrigatórias no protocolo de investigação da EM, algumas sequências avançadas conseguem ilustrar características altamente sugestivas da doença e diferenciá-las de outras situações clínicas prevalentes. A sequência de suscetibilidade magnética (SWI), por exemplo, ajuda a identificar a veia central, presente em até 90% das lesões encefálicas em pacientes com EM, em contraste com lesões associadas à doença vascular (figura 4).

Figura 4 | Algumas sequências, como a técnica de suscetibilidade magnética (SWI) (A), são úteis para visualizar veias intraparenquimatosas e podem identificar a veia central (seta em a), encontrada na maior parte das lesões de pacientes com EM. Nessas imagens, confirma-se a presença de uma lesão com alto sinal em T2 na imagem FLAIR (seta em B).
A RM tem igualmente um papel fundamental no seguimento da EM, uma vez que detecta o surgimento de novas lesões, o crescimento de lesões existentes e ainda novas lesões com realce ao contraste paramagnético. Um dos critérios para a definição de eficácia de tratamento nos pacientes com EM inclui o conceito de ausência de sinais de atividade da doença (NEDA, do inglês, no evidence of disease activity), cuja definição abrange ausência de atividade radiológica durante avaliações consecutivas. A detecção de sinais radiológicos desfavoráveis, mesmo que assintomáticos, pode sinalizar falha terapêutica e a necessidade de uma intervenção farmacológica mais eficaz.
Doenças do espectro da neuromielite óptica
No fim do século 19, Eugène Devic descreveu uma entidade clínica caracterizada por neurite óptica bilateral e mielites transversas, que ficou primariamente conhecida como uma condição monofásica, a doença de Devic. Mais tarde, em meados do século 20, casos recorrentes foram descritos e, por se assemelharem a uma doença inflamatória e desmielinizante, ficaram caracterizados como a forma opticoespinhal da EM. Contudo, a doença de Devic frequentemente apresenta uma resposta desfavorável às terapias de EM, levantando a hipótese de que esse quadro poderia corresponder a uma doença distinta. Em 2004, a descoberta da associação das formas opticoespinhais da EM com o anticorpo contra os canais de aquaporina-4 (AQP4-IgG) forneceu um marcador para a condição, que seria, a partir de então, denominada neuromielite óptica (NMO), uma entidade distinta da EM.
A descoberta desse biomarcador facilitou a descrição de achados de RM sugestivos de NMO. Diferentemente da EM, as lesões da NMO não possuem distribuição perivenular, mas tendem a se distribuir ao redor das regiões ricas em receptores de AQP4 – em torno do canal central da medula espinhal, nas regiões subependimárias e plexo coroide, na área postrema (transição entre o canal ependimário central bulbocervical e o quarto ventrículo), nos processos astrocitários perivasculares e em diversas células das vias ópticas, da retina até a região pós-quiasmática. Essa rica distribuição dos receptores de AQP4 no sistema nervoso central explica não somente a presença de lesões encefálicas na NMO, mas também os achados de imagem sugestivos do espectro da neuromielite óptica (figura 5).

Figura 5 | Distribuição de lesões sugestivas do espectro da NMO. A imagem (A) demonstra uma mielite transversa longitudinalmente extensa (LETM) com localização centromedular, ao redor do canal central da medula. Em (B), vemos uma lesão extensa na superfície ependimária, delineando o esplênio do corpo caloso e a superfície do átrio do ventrículo lateral direito. Outras localizações frequentes de lesões de NMOSD são o quiasma óptico (C), o quarto ventrículo (D) e a superfície do terceiro ventrículo (E), com acometimento da região dos tálamos e diencéfalo. A última imagem (F) demonstra um esquema, em linhas pontilhadas, de regiões ricas em receptores de AQP4.
O último consenso internacional de diagnóstico da NMO, descrito por Wingerchuck et al, em 2015, definiu o espectro da neuromielite óptica (NMOSD, do inglês, neuromyelitis optica spectrum disorders), incluindo a NMO com antiAQP4+ e outras apresentações com achados clínicos e de imagem semelhantes, além de outras doenças autoimunes e síndromes desmielinizantes. Ainda não está totalmente esclarecido o quanto essas afecções fazem parte de uma entidade patológica única ou de um espectro amplo de doenças neurológicas. Entretanto, a acelerada descoberta de outros biomarcadores sorológicos, associados a alguns sinais de imagem distintos, está contribuindo para que novas cores dentro desse espectro possam ser identificadas, conforme ilustraremos adiante.
Anti-AQP4 e anti-MOG: novos dilemas
Estudos recentes mostram que, entre os pacientes com apresentação clássica de NMOSD, cerca de 60% a 90% têm testes sorológicos positivos para AQP4-IgG. Dentro da parcela negativa para esse anticorpo, novos marcadores têm sido testados, possibilitando o encontro de associações com outras doenças autoimunes. Dos pacientes soronegativos para AQP4-IgG, uma parcela significativa demonstrou positividade para anticorpos contra a glicoproteína do oligodendrócito da mielina (anti-MOG-IgG ou anti-MOG, sendo MOG a sigla em inglês de myelin oligodendrocyte glicoprotein). Muitos dos aspectos de imagem dos pacientes com NMOSD anti-AQP4+ e anti-MOG+ podem ser semelhantes e superponíveis, mas estudos mais recentes têm demonstrado algumas diferenças entre os dois grupos, o que, no futuro próximo, pode ajudar a separá-los.
Nas apresentações medulares, ambos os grupos apresentam uma frequência alta de mielites transversas longitudinalmente extensas (com extensão longitudinal igual ou superior à de três corpos vertebrais). No entanto, cerca de um terço dos pacientes anti-MOG+ pode ter mielites curtas únicas ou multifocais (figura 6). Do ponto de vista de localização, os indivíduos anti-MOG+ exibem uma frequência um pouco mais elevada de lesões no cone medular no primeiro surto. Essas lesões, porém, não são patognomônicas desses pacientes. Por outro lado, indivíduos com NMOSD anti-AQP4+ aparentemente têm uma frequência maior de acometimento da área postrema. Outro achado potencialmente distintivo entre os dois quadros são as bright spotty lesions, caracterizadas por focos altamente hidratados nas lesões medulares, com sinal igual ou superior ao liquor, que parecem ser mais frequentes nos pacientes anti-AQP4+, podendo estar presentes em cerca de 30% a 50% das mielites agudas desses indivíduos.
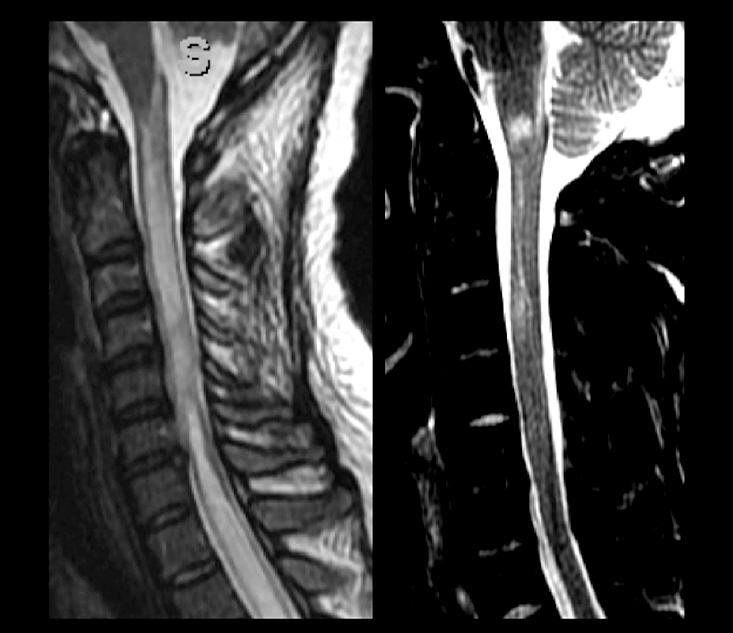
Figura 6 | Lesões medulares em paciente com NMOSD (A) demonstram uma mielite transversa longitudinalmente extensa, com acometimento da transição bulbomedular e da área postrema. A imagem (B) mostra paciente anti-MOG+ com lesões medulares mais curtas, também acometendo a junção bulbomedular.
A análise das órbitas e dos nervos ópticos também pode fornecer potenciais sinais diferenciais dentro do espectro da NMO. De modo similar à medula, as lesões das NMOSD nos nervos ópticos costumam ser extensas – mais do que as neurites relacionadas à EM – e acometer mais da metade de sua extensão. Mas, nos pacientes anti-MOG+, existe uma frequência maior de neurites bilaterais e anteriores acometendo a porção intraorbital dos nervos ópticos. Por outro lado, os pacientes anti-AQP4+ têm uma predileção para as porções posteriores dos nervos ópticos, com acometimento das porções cisternais, quiasmáticas e pós-quiasmáticas (figura 7).
 Figura 7 | Neurite óptica em paciente anti-AQP4+ (A e B), que apresenta hipersinal em T2 no quiasma óptico (A), com realce após a injeção do contraste paramagnético (b). Nos pacientes com NMOSD anti-MOG+ (C e D), observam-se com maior frequência neurites bilaterais acometendo os segmentos anteriores dos nervos ópticos (C), assim como o realce periférico no nervo óptico (D), que caracteriza perineurite.
Figura 7 | Neurite óptica em paciente anti-AQP4+ (A e B), que apresenta hipersinal em T2 no quiasma óptico (A), com realce após a injeção do contraste paramagnético (b). Nos pacientes com NMOSD anti-MOG+ (C e D), observam-se com maior frequência neurites bilaterais acometendo os segmentos anteriores dos nervos ópticos (C), assim como o realce periférico no nervo óptico (D), que caracteriza perineurite.
Apesar de as descrições mais antigas da doença de Devic ou NMO apontarem para ausência ou raridade de lesões encefálicas nesses quadros, sabe-se hoje que tais pacientes têm uma incidência muito baixa de lesões típicas de EM, mas podem apresentar encefalites e lesões encefálicas sugestivas de NMOSD. Surpreendentemente, em adultos, as lesões encefálicas são mais frequentes em pacientes anti-AQP4+ do que naqueles anti-MOG+. Contudo, talvez por essas apresentações serem menos frequentes do que as lesões encefálicas relacionadas à EM ou por ainda não haver estudos suficientes, os tipos de acometimento encefálico entre as síndromes NMOSD com frequência se sobrepõem.
Algumas lesões sabidamente são mais comuns em indivíduos anti-MOG+, como as de tronco encefálico, sobretudo as romboencefalites e as lesões de pedúnculo cerebelar, enquanto as subependimárias lineares extensas são bastante prevalentes nos indivíduos anti-AQP4+. No entanto, as lesões encefálicas, em ambas as síndromes, podem ser superponíveis e ainda não diferenciam claramente as duas entidades.
RESSONÂNCIA MAGNÉTICA DE CRÂNIO COM LESIONQUANT®
Desenvolvido pela CorTechs Labs, o LesionQuant® é um software que, por meio dos estudos do encéfalo por RM, associa informações das sequências 3D T1 e FLAIR, permitindo a identificação e a quantificação volumétrica de lesões cerebrais de forma rápida e completamente automatizada.
Com aplicação bem estabelecida na EM, a técnica permite, de modo acurado e reprodutível, uma melhor avaliação da atividade da doença, da progressão das lesões ao longo do tempo e da resposta terapêutica.
Os resultados do LesionQuant® são disponibilizados em relatórios detalhados, otimizados e de fácil interpretação dos achados, com foco nas informações mais relevantes. As avaliações quantitativas e longitudinais das lesões cerebrais nos pacientes com EM auxiliam o planejamento terapêutico e o monitoramento da progressão da doença.
O software analisa o número de lesões encefálicas, a distribuição anatômica das lesões (segmentação) e a alteração do número e do volume de lesões (progressão) ao longo do tempo, além de quantificar volumetricamente as estruturas encefálicas, o que é feito com um módulo conjunto com o NeuroQuant®.
Vale lembrar que, para a realização do LesionQuant®, é importante solicitar, no pedido médico, a inclusão da técnica ou informar a necessidade do estudo da volumetria das lesões.
Diferenciais da técnica:
• Identificação e quantificação volumétrica rápida e precisa das lesões cerebrais: número, volume e relação (%) entre tamanho da lesão e volume intracraniano
• Utilização de uma paleta de cores para representação das lesões: segmentação em cores por lesão e por região anatômica (leucocortical, periventricular, infratentorial e substância branca profunda)
• Análise longitudinal por meio da avaliação do aumento ou da diminuição do número e volume de lesões em relação a estudos anteriores
• Análise totalmente automatizada da imagem, o que confere consistência, precisão e reprodutibilidade ao resultado
• Histograma da distribuição das lesões: número versus tamanho
• Avaliação volumétrica das estruturas cerebrais, com comparação com percentis de normalidade, incluindo gráficos de referência para sexo e idade
• Análise possível para ampla variação de faixa etária (de 3 a 100 anos)
• Informações armazenadas de forma segura em sistemas instalados localmente ou em nuvem




CONSULTORIA MÉDICA
Neuroimagem
Dr. Antônio Carlos Martins Maia Júnior
Dra. Bruna Garbugio Dutra
Dr. Carlos Jorge da Silva
Dr. Carlos Toyama
Dra. Carolina de Medeiros Rimkus
Dra. Claudia da Costa Leite
Dr. Diego Cardoso Fragoso
Dr. Douglas Mendes Nunes
Dra. Germana Titoneli dos Santos
Dr. Henrique Bortot Zuppani
Dr. Leandro Tavares Lucato
Dr. Lucas Ávila Lessa Garcia
Dr. Thiago Pereira Donoso Scoppetta
Imunologia e Centro de Infusões Fleury
Dr. Alexandre Wagner Silva de Souza
Dr. Luis Eduardo Coelho Andrade
Dr. Sandro Felix Perazzio
Dra. Suellen Narimatsu
Outros artigos
Ginecologista, o relógio biológico de sua paciente está correndo. Seu atendimento acompanha esse tempo?
Ginecologista, o relógio biológico de sua paciente está correndo.
Investigação de hiperprolactinemia e macroprolactina
Saiba como contornar os desafios na interpretação dos resultados da dosagem de prolactina
Strain atrial: uma nova ferramenta clínica para avaliação da função cardíaca
Strain atrial: uma nova ferramenta clínica para avaliação da função cardíaca
Nirsevimabe ajuda a prevenir a infecção e complicações causadas pelo VSR em lactentes
Nirsevimabe ajuda a prevenir a infecção e complicações causadas pelo VSR em lactentes